Pequeñeces (y ii)
(continuación de Pequeñeces (i))
En efecto, cosas pequeñas y hechos insignificantes pueden cambiar nuestras vidas para siempre. Pero aún hay otra pequeñez que, de hecho, nos mantiene vivos.
A todo el mundo le suena que H2O es la fórmula química del agua. Una fórmula química es una forma práctica de contar cuántos átomos de cada elemento forman parte de un compuesto químico. H2O significa que en una molécula de agua hay dos átomos de hidrógeno y un átomo de oxígeno. El átomo de oxígeno tiene dos enlaces libres (tiene valencia 2) y el de hidrógeno tiene un enlace libre (valencia 1). Un átomo de oxígeno cuyos dos enlaces están ocupados por sendos átomos de hidrógeno forma una molécula de agua.
Podemos imaginarnos un átomo como una bolita y un enlace como un bastoncillo que une dos bolitas. El átomo de oxígeno es una bolita en el centro de la molécula con dos enlaces hacia los lados, cada uno conectado a una bolita algo más pequeña que representa al átoma de hidrógeno. Estos dos enlaces del átomo de oxígeno no están perfectamente alineados, lo cual significaría un ángulo de 180°, sino que forman un ángulo ligeramente obtuso (de exactamente 104.45°). Un hecho aparentemente insignificante. Pero sólo aparentemente.
La electronegatividad del oxígeno (3.44) es más elevada que la del hidrógeno (2.20), es decir, el átomo de oxígeno atrae electrones con más fuerza que el átomo de hidrógeno.
El ángulo de 104.45° entre los enlaces del átomo de oxígeno significa que un lado de la molécula de agua (donde se encuentra el oxígeno) atrae con más fuerza a los electrones que el otro (el de los hidrógenos). En términos químicos, se dice que la molécula de agua es un dipolo. Una molécula de agua es, en cierto modo, como un diminuto imán, con su polo negativo y su polo positivo.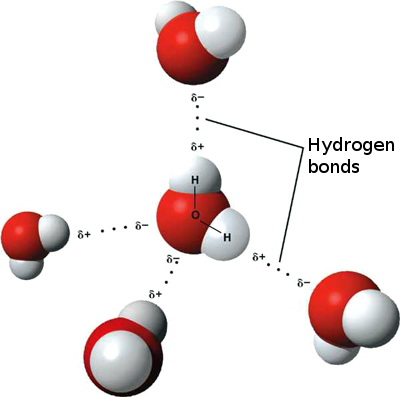
(Imagen de Wikimedia Commons)
Lo que ocurre es que el lado del oxígeno (el polo negativo) atrae a todos los electrones cercanos, incluyendo a los electrones de los átomos de hidrógeno de otras moléculas de agua. Esto hace que las distintas moléculas de agua estén ligadas entre sí por su naturaleza dipolar. Este tipo de enlace se llama puente de hidrógeno y es más débil que un enlace normal (covalente), como el que mantiene los átomos de una molécula ligados entre sí. Los enlaces por puente de hidrógeno entre las moléculas de agua son responsables de que el agua sea líquida a temperatura ambiente, porque se necesita energía adicional (en forma de calor) para romperlos.
Detengámonos un instante a reflexionar sobre ello. Si el átomo de oxígeno tuviera sus enlaces alienados, la molécula de agua no tendría polo positivo ni polo negativo, porque los átomos de hidrógeno anularían la carga negativa del oxígeno. El punto de ebullición del agua sería mucho más bajo que 100°C. De hecho, sin puentes de hidrógeno, el agua sería vapor a temperatura ambiente.
Imaginemos que todos los átomos de oxígeno alinearan de repente sus enlaces. Casi toda el agua en estado líquido de nuestra planeta se evaporaría al instante. La vida tal y como la conocemos dejaría de existir. En un abrir y cerrar de ojos.
¡Menos mal que existe ese ángulo de 104.45°!

 english version
english version








No hay comentarios:
Publicar un comentario